Durchbruch Für Sanofi: Rilzabrutinib Erhält Orphan-Drug-Designation Der FDA

Table of Contents
Was bedeutet die Orphan-Drug-Designation für Rilzabrutinib?
Die Orphan-Drug-Designation, verliehen von der FDA für Medikamente zur Behandlung seltener Krankheiten, bietet Sanofi entscheidende Vorteile im Entwicklungsprozess von Rilzabrutinib. Diese Vorteile beschleunigen nicht nur die Markteinführung, sondern sichern auch den finanziellen Erfolg des Projekts.
-
Schnellere Entwicklung und Zulassung: Der ODD-Status ermöglicht beschleunigte Prüfverfahren und eine schnellere Bearbeitung der Zulassungsunterlagen durch die FDA. Dies verkürzt die Zeit bis zur Markteinführung und bringt das Medikament schneller zu den Patienten.
-
Finanzielle Anreize für Sanofi: Die Designation beinhaltet Steuererleichterungen und finanzielle Anreize, die die Kosten für Forschung und Entwicklung von Rilzabrutinib reduzieren und somit die Investitionen in klinische Studien unterstützen.
-
Marktvorteil gegenüber Konkurrenzprodukten: Die Orphan-Drug-Designation gewährt nach der Zulassung eine Marktexklusivität für einen bestimmten Zeitraum. Dies schützt Sanofi vor direkter Konkurrenz und sichert einen erheblichen Marktanteil.
-
Erleichterte klinische Studien: Die FDA bietet Unterstützung und Beratung bei der Planung und Durchführung der klinischen Studien, was den Prozess vereinfacht und beschleunigt.
Rilzabrutinib: Wirkmechanismus und Anwendungsgebiete
Rilzabrutinib ist ein selektiver, kleinmolekularer Bruton-Tyrosinkinase (BTK)-Inhibitor. BTK spielt eine wichtige Rolle in der Signalübertragung verschiedener Immunzellen. Durch die Hemmung von BTK kann Rilzabrutinib die Aktivität dieser Zellen modulieren, was es zu einem vielversprechenden Therapieansatz für bestimmte hämatologische Erkrankungen macht.
Rilzabrutinib wird derzeit für die Behandlung verschiedener Erkrankungen entwickelt, wobei der Fokus auf einer seltenen Erkrankung liegt, für die die Orphan-Drug-Designation erteilt wurde. Die spezifischen Anwendungsgebiete werden in zukünftigen Zulassungsanträgen genauer definiert werden.
-
Spezifischer Wirkstoff und Zielmolekül: Der selektive Wirkmechanismus von Rilzabrutinib bietet die Möglichkeit, gezielt die krankheitsauslösenden Prozesse zu beeinflussen, während gleichzeitig unerwünschte Nebenwirkungen minimiert werden.
-
Vorteile gegenüber bestehenden Therapien: Rilzabrutinib hat das Potenzial, die bestehenden Behandlungsoptionen durch verbesserte Wirksamkeit und verträglicheres Nebenwirkungsprofil zu ergänzen.
-
Potenzial zur Verbesserung der Behandlungsergebnisse: Vorläufige Studiendaten zeigen vielversprechende Ergebnisse, die auf eine signifikante Verbesserung der Behandlungsergebnisse bei Patienten mit seltenen Erkrankungen hinweisen.
Die Bedeutung der FDA-Zulassung im globalen Kontext
Die FDA-Zulassung ist von großer Bedeutung für die globale Verbreitung von Rilzabrutinib. Eine positive Bewertung durch die FDA wird als wichtiges Qualitätsmerkmal angesehen und beeinflusst positiv die Entscheidungen anderer Zulassungsbehörden weltweit, wie beispielsweise der Europäischen Arzneimittel-Agentur (EMA).
-
Globale Relevanz der FDA-Zulassung: Eine erfolgreiche FDA-Zulassung stärkt das Vertrauen in die Sicherheit und Wirksamkeit von Rilzabrutinib und erleichtert den Zulassungsprozess in anderen Ländern.
-
Auswirkungen auf die Patientenversorgung weltweit: Eine schnelle und erfolgreiche globale Zulassung bedeutet, dass Patienten weltweit schneller Zugang zu dieser innovativen Therapie erhalten.
-
Potenzial für zukünftige Zulassungen in anderen Ländern: Die Orphan-Drug-Designation in den USA erleichtert die Beantragung vergleichbarer Designationen in anderen Ländern, was die globale Markteinführung von Rilzabrutinib weiter beschleunigen kann.
Ausblick: Nächste Schritte in der Entwicklung von Rilzabrutinib
Die Orphan-Drug-Designation der FDA ist ein wichtiger Schritt, aber der Weg zur Markteinführung ist noch nicht abgeschlossen. Sanofi wird in den kommenden Monaten und Jahren weitere klinische Studien durchführen und die Zulassungsanträge in verschiedenen Ländern einreichen.
-
Geplante Phase-III-Studien: Sanofi wird weitere umfangreiche Phase-III-Studien durchführen, um die Wirksamkeit und Sicherheit von Rilzabrutinib in größeren Patientengruppen zu bestätigen.
-
Zeitrahmen für die Markteinführung: Der genaue Zeitrahmen für die Markteinführung hängt vom erfolgreichen Abschluss der klinischen Studien und dem Zulassungsprozess in den verschiedenen Ländern ab.
-
Potenzial für weitere Indikationen: Die vielversprechenden Ergebnisse der bisherigen Studien legen nahe, dass Rilzabrutinib auch für die Behandlung weiterer seltener Erkrankungen geeignet sein könnte.
Schlussfolgerung: Rilzabrutinib – Ein Hoffnungsschimmer für Patienten mit seltenen Erkrankungen
Die Orphan-Drug-Designation der FDA für Rilzabrutinib ist ein bedeutender Erfolg für Sanofi und vor allem für Patienten mit seltenen Erkrankungen. Diese Auszeichnung unterstreicht das enorme Potenzial von Rilzabrutinib, die Behandlungslandschaft für diese Patientengruppe grundlegend zu verändern. Die beschleunigte Entwicklung und die Aussicht auf eine schnellere Markteinführung bieten Hoffnung auf eine verbesserte Therapie und eine höhere Lebensqualität. Informieren Sie sich weiter über die Rilzabrutinib Entwicklung, die Orphan Drug Rilzabrutinib und die Sanofi Rilzabrutinib Strategie, um mehr über diese vielversprechende Therapie zu erfahren.

Featured Posts
-
 Sanofis Chlamydia Vaccine Fda Grants Fast Track Designation
May 31, 2025
Sanofis Chlamydia Vaccine Fda Grants Fast Track Designation
May 31, 2025 -
 Zuckerberg And Trump The Intersection Of Tech And Politics In A New Era
May 31, 2025
Zuckerberg And Trump The Intersection Of Tech And Politics In A New Era
May 31, 2025 -
 The Six Golden Rules Of Office Lunch Etiquette
May 31, 2025
The Six Golden Rules Of Office Lunch Etiquette
May 31, 2025 -
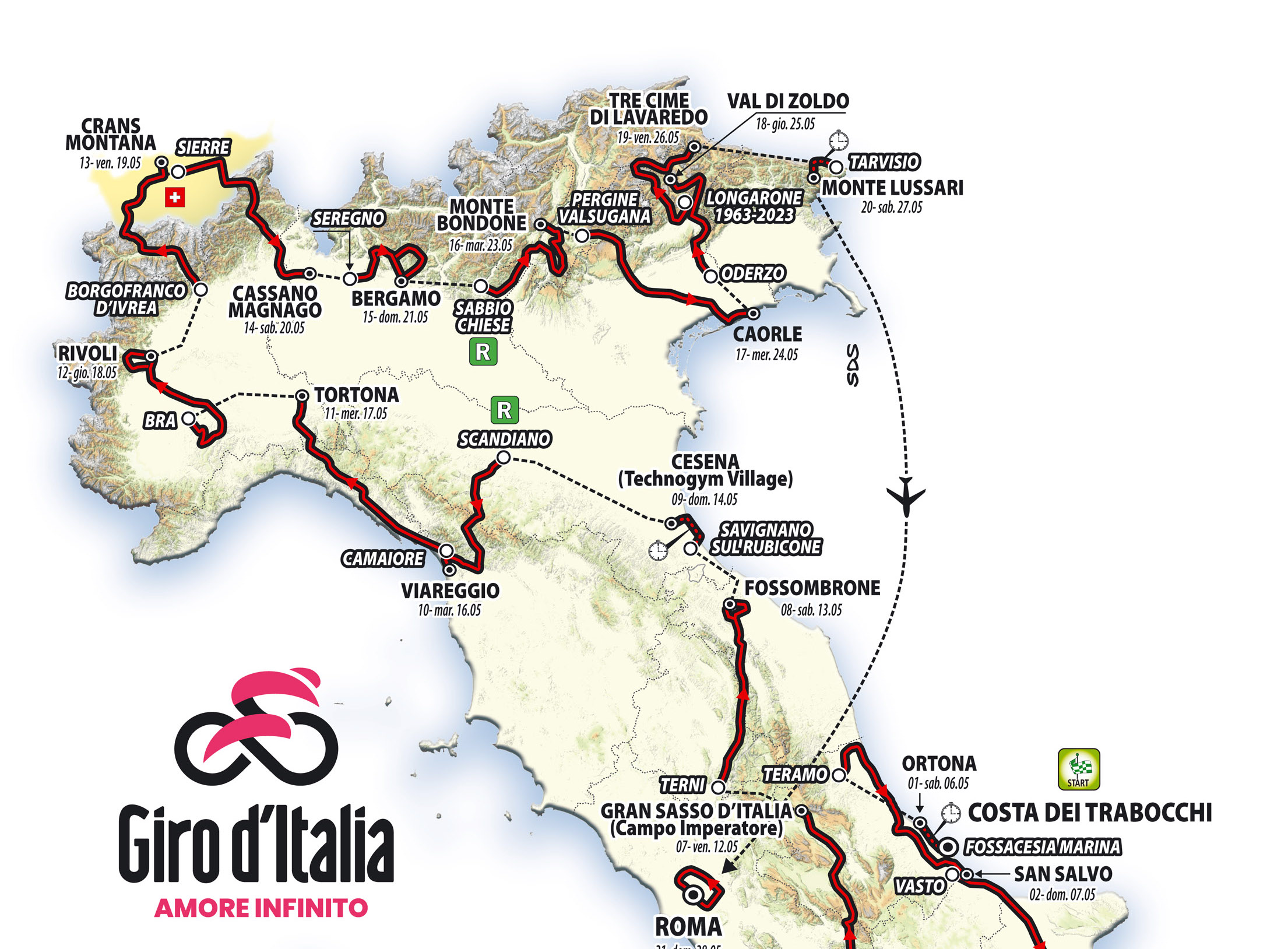 Final Stage Of Giro D Italia 2025 Set For Vatican City
May 31, 2025
Final Stage Of Giro D Italia 2025 Set For Vatican City
May 31, 2025 -
 Molly Jong Fast On Tomorrow Is A New Day A Publishers Weekly Conversation
May 31, 2025
Molly Jong Fast On Tomorrow Is A New Day A Publishers Weekly Conversation
May 31, 2025
